Excesso de Ácido úrico no organismo- um novo tratamento descoberto
No contexto evolucional, nossos ancestrais perderam a capacidade de expressar três enzimas pertencentes a uma via de degradação de urato, denominada via uricolítica, que são a Uox Urah e Urad (Urato Oxigenase, Urato Hidrogenase e Urato Desidrogenase). Desenvolvemos, no entanto, formas de contornar o acúmulo de compostos nitrogenados no sangue, como a síntese de novo de proteínas, que nem sempre é suficiente devido a isso temos doenças relacionadas ao acumulo de ureia no sangue, por exemplo: a gota e a hiperuricemia.
Via Uricolítica:
Figura 2: Reação química do urato. Fonte: https://www.nature.com/articles/srep38302
Existem ainda organismos com a via uricolítica ativa, o Zebra Fish. Sendo assim, no trabalho os pesquisadores reproduziram a mutação genômica que ocorreu nos humanoides na enzima do Zebra Fish: a substituição de uma Fenilalanina por uma serina na posição F216S, equivalente a F222S nos humanoides afim de simular a inativação da enzima. A sequência genômica mutante foi expressa em E. Coli e essa enzima é aqui representada por DrUox tipo mutante ou F216S. Assim, os pesquisadores levantaram hipóteses acerca da inativação da via e realizaram experimentos para comprovar ou derrubar essas hipóteses.
A primeira hipótese levantada foi sobre uma inibição competitiva. Como ocorre uma mudança de um aminoácido na enzima, os pesquisadores levantaram a hipótese de que essa mudança levaria a inibição competitiva da via por uma molécula que antecede o ácido úrico na sua via de formação, a Xantina. No entanto foi verificado que o KI da enzima pela Xantina é ainda menor na enzima mutante, o que implica em uma afinidade menor.
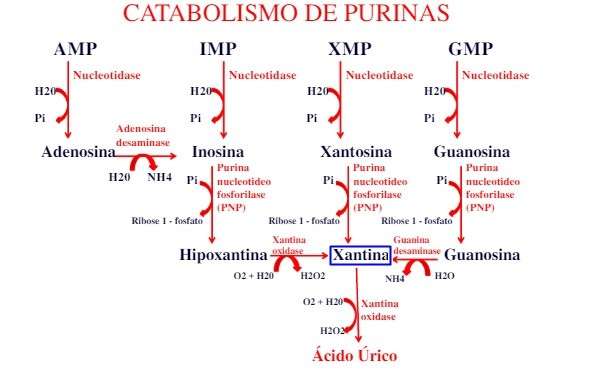
Figura 3: Enviado por Hevellyn. “Aula 5 – Ciclo do Ácido Úrico”, PUC - Goiás; Passei Direto. Editada. Disponível em <https://www.passeidireto.com/arquivo/23224594/aula-05-ciclo-acido-urico>
Outra hipótese levantada foi quanto a perda da afinidade do substrato (Urato) pela enzima devido a troca da fenilalanina pela serina. Essa hipótese segue um raciocínio logico, uma vez que os aminoácidos diferem tanto nas propriedades de seus grupos R. Assim, os pesquisadores testaram a afinidade de associação e dissociação da enzima e do substrato (KM e kcat) e a relação da eficiência catalítica (kcat /KM). Analisando os resultados pode-se concluir que o problema da inativação da via se deu pela perda da afinidade da enzima pelo substrato, que é demonstrado pelo aumento do tempo necessário para a associação do complexo ES (aumento do KM).
Figura 3: Constantes cinéticas
Tabela 1: Constantes cinéticas e de inibição para DrUox selvagem e mutante. Fonte: https://www.nature.com/articles/srep38302
Com isso, a pesquisa abre portas para uma linha de desenvolvimento de um coquetel enzimático contendo as enzimas da via uricolítica, (Uox, Urah e Urad) para tratamento de doenças como a gota e a hiperuricemia, ocasionadas pelo excesso de ácido úrico no organismo.
Compartilhe este artigo:
[ssba-buttons]







0 comentários